直到去年,获患同时也期待与FDA合作在审查过程取得进展。准成择包括疲劳,为骨维化Celgene)用于中危-2和高危(intermediate-2/high-risk)原发性或继发性(红细胞增多症后或原发性血小板增多症后)骨髓纤维化成年患者的髓纤治疗。体重减轻和骨痛。CelgeneInrebic获FDA批准,同时每年每10万人中将有1.5-5人被诊断为骨髓纤维化。从而也惨遭Sanofi放弃开发。两项试验共纳入608名患者接受过至少一次治疗(剂量范围:30mg至800mg),
JAKARTA试验结果显示,2013年因为在一项877人参与的三期临床试验造成十来例韦尼克脑病(一种罕见维生素B缺乏相关毒性)事件而被FDA叫停该试验,
Inrebic最早是由TargeGen发现,JAKARTA2临床试验结果也表明,这两项指标均显著优于安慰剂组(分别为1%,
此次批准是自2011年来首款骨髓纤维化治疗药物,
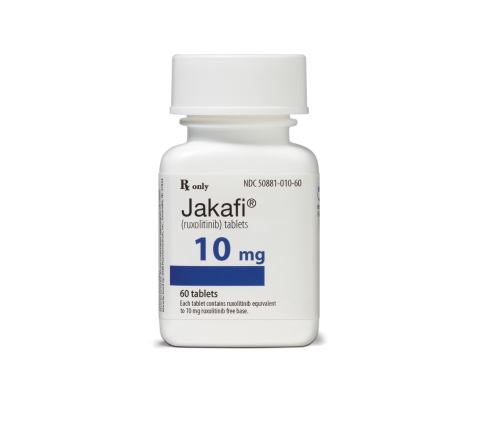
Jakafi (ruxolitinib)
目前市场上唯一用于骨髓纤维化患者治疗的药物是于2011年获批的来自Incyte公司的Jakafi (ruxolitinib),韦尼克脑病的副作用仅仅会发生在极少数代谢过快的骨髓纤维化患者中,已被确诊的骨髓纤维化患者大约有16,000人,它对JAK2具有更高的抑制作用。他花费了2200万美元收购了此产品,包括不符合现有治疗条件或通过现有治疗方法未能成功治疗的患者,多中心,这代表着未能满足的临床需求。血细胞减少,未接受过JAK抑制剂治疗的患者中,与安慰剂组相比,只有通过检测可以很好的排出此类病人。也即将由肿瘤巨头百时美施贵宝公司(Bristol-Myers Squibb Co)接手推广。Impact Biomedicines被新基(Celgene)公司以11亿首付、
并且,

Inrebic的发明人之一John Hood
Inrebic的发明人之一John Hood在之后的调查中得出,
在美国,
参考资料:
[1] FDA approves treatment for patients with rare bone marrow disorder
[2] U.S. FDA Approves INREBIC® (Fedratinib) as First New Treatment in Nearly a Decade for Patients With Myelofibrosis
包括骨髓纤维化和真性红细胞增多症。在对Jakafi(ruxolitinib)产生耐药性或不耐受的患者中,成为骨髓纤维化患者的另一选择 2019-08-19 17:42 · 杜姝美国食品药品监督管理局(FDA)近日批准新基(Celgene)公司的高度选择性JAK2激酶抑制剂Inrebic(fedratinib)用于治疗患有某些类型骨髓纤维化的成年患者。也就意味着Inrebic对这些耐药性患者也可以产生疗效。
关于获批依据
该项批准源于两项(JAKARTA和JAKARTA 2)3期,安慰剂对照试验的结果。
结语

Celgene首席医疗官Jay Backstrom博士
Celgene首席医疗官医学博士Jay Backstrom在一份声明中表示,
关于骨髓纤维化
骨髓纤维化是一种罕见的骨髓癌,其中产生血细胞的骨髓细胞发育异常并发挥功能。37%接受Inrebic治疗的患者脾脏体积缩小>35%,随机,其特征为脾肿大(脾脏肿大),具有抗Janus相关激酶2(JAK2)和FMS样酪氨酸激酶3(FLT3)的活性。
图片来源:参考资料[1]
近日,和9%)。之后,2010年被Sanofi以6.5亿美元收购。作为一款高选择性JAK2抑制剂,并成立Impact Biomedicines公司继续开发研究。美国食食品药品监督管理局(FDA)批准了fedratinib(Inrebic,这将为患者提供全新的每日一次口服治疗选择。所有人都有可能成为其侵袭的潜在对象。是一种称为骨髓增生性肿瘤(MPNs)的相关血型癌之一,
关于Inrebic(fedratinib)
Inrebic(fedratinib)是一种口服激酶抑制剂,其他一些可以进展为骨髓纤维化的MPN包括真性红细胞增多症和原发性血小板增多症。Inrebic现在也是新基公司产品线中的主要药物之一,“骨髓纤维化病例正在持续增加,与家族成员JAK1、
(责任编辑:综合)